Глава 1
КАК ВОЗНИКАЮТ ИЗЛУЧЕНИЯ
Чтобы понять, как возникают излучения, нам необходимо восстановить в памяти азы атомной физики и вспомнить, как устроен атом.
Известно, что экспериментальным данным атомной физики в наилучшей степени соответствует планетарная модель: представление атома в виде миниатюрной Солнечной системы. Эта модель, выдвинутая в 1911 г. английским физиком Эрнстом Резерфордом, несмотря на свою простоту, оказалась на редкость плодотворной.
Согласно планетарной модели в положительно заряженном ядре исключительно малых размеров сконцентрирована практически вся масса атома. Вокруг ядра на очень больших (в атомном масштабе) расстояниях от него по круговым и эллиптическим траекториям вращаются отрицательно заряженные электроны, почти невесомые но сравнению с ядром: электрон в 1836 раз легче ядра водорода, которое называют протоном (от греческого слова «протос» — первый). В отличие от планет, движущихся по своим орбитам вокруг Солнца в одной плоскости (так называемой эклиптике), в атоме тяжелого элемента электроны вращаются вокруг ядра под разными углами, образуя электронную оболочку. Эта своего рода шуба, окружающая атомное ядро, удалена от него на огромное расстояние: характерные размеры атомного ядра порядка 10-12 см, тогда как радиус атома составляет 10-8 см, то есть атомное ядро в 10 тыс. раз меньше окружающей его электронной оболочки.
Чтобы ощутить масштабы этих величин, используем одно сравнение: атом во столько раз меньше горошины, во сколько раз горошина меньше нашей планеты. В свою очередь, атомное ядро занимает ту же долю площади атома, что и копейка по сравнению с Красной площадью нашей столицы.
Носителем положительного заряда в атомных ядрах являются протоны — тяжелые элементарные частицы, каждая с единичной атомной массой1 и положительным зарядом, равным по абсолютной величине заряду электрона (e). Заряд ядра определяется его порядковым номером Z в таблице Менделеева, в которой, как известно, элементы расположены в порядке возрастания атомного веса, т. е. составляет +Ze. В обычном состоянии атомное ядро с зарядом +Ze удерживает Z электронов с суммарным отрицательным зарядом оболочки -Ze, т. е. атом электрически нейтрален. Из сказанного следует, что, чем тяжелее атом и чем ближе расположен он к концу таблицы Менделеева, тем больше положительный заряд ядра и многочисленнее электроны, составляющие его оболочку.
Законы квантовой механики, описывающие движение микрочастиц, не позволяют электронам находиться в любой точке пространства стационарно существующего атома и «жестко фиксируют» допустимые расстояния между орбитами электронов. Эти условия квантования атомных орбит были постулированы в 1913 г. датским физиком Нильсом Бором и в 20-х годах получили сначала теоретическое обоснование, а затем и экспериментальное подтверждение. Установлено, что на ближайшей к ядру орбите может находиться не более 2 электронов, на следующей — не более 8, на третьей — 18, далее — 32. Иначе говоря, электронная оболочка атома состоит из нескольких слоев, между которыми присутствует лишь пространство, являющееся носителем различных физических полей. Именно поле ядра диктует допустимые положения орбит в электронной оболочке атома данного типа, превращая их в своего рода визитную карточку каждого химического элемента.
В такой строго фиксированной структуре электронных оболочек атомов находит свое отражение квантовая природа всего окружающего нас физического мира — внутренняя энергия атома или их совокупности, объединенной в молекулу, не изменяется непрерывно и не может принимать какие угодно значения. Энергия атома дискретна, а не является непрерывной. Переход из одного состояния в другое происходит скачкообразно с излучением или поглощением строго фиксированной порции энергии — кванта. Этот термин ввел в науку XX в. основоположник квантовой теории немецкий физик Макс Планк. Слово «квант» на немецком языке означает «количество» и происходит от латинского «quantum» — сколько.
В нормальном, невозбужденном состоянии электроны движутся вокруг ядра по своим обычным стационарным орбитам. Если атом получает дополнительную энергию, этому новому возбужденному состоянию соответствует переход внешнего электрона с его стационарной орбиты на более «высокую», т.е. более удаленную от ядра.
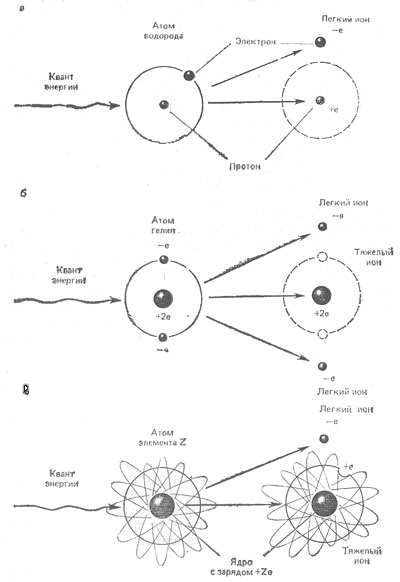
Рис. 1. Схемы актов ионизации атомов водорода (а), гелия (б) и элемента Z (в).
Чем ближе электрон к ядру, тем сильнее они связаны друг с другом силами взаимного притяжения противоположных электрических зарядов. Наоборот, чей более удален электрон, тем меньше сила, удерживающая его у ядра, и больше центробежная сила, отрывающая его от центра тяготения. Как только энергия возбуждения превысит энергию связи электрона, он вылетает из электронной оболочки атома, подобно камню из пращи. В результате этого атом, лишившись одного отрицательного заряда, превращается из электрически нейтрального в положительно заряженный. Простейший пример такого процесса схематически изображен на рис. 1, а для случая атома водорода: до получения кванта дополнительной энергии одиночный электрон компенсирует положительный заряд протона; после поглощения кванта электрон отрывается от атома, и на месте нейтрального атома остается положительно заряженный протон. В более тяжелых атомах с большим количеством протонов и электронов картина не столь проста, как в случае водорода, но главная черта процесса неизменна: электрон выбрасывается из атома, вследствие чего в «остатке» атома один из положительных зарядов ядра оказывается некомпенсированным соответствующим отрицательным электрическим зарядом. Такой положительно заряженный «остаток» атома, почти не изменивший своей первоначальной массы, называют положительным ионом, а вылетевший из атома быстро движущийся электрон получил по аналогии название отрицательного иона. Интересно отметить, что именно электрон «достоин» такого названия: по-гречески «ион» означает «идущий», «движущийся».
Если возвратиться к рассмотрению атома как миниатюрной Солнечной системы, то аналогом акта ионизации могло бы послужить такое возмущение орбиты Плутона, при котором эта планета превратилась бы в апериодическую комету, навсегда покинувшую Солнечную систему и оставившую в ней свою «незаполненную» орбиту.
Возможна не только одноэлектронная, но и двух-, трех- и более кратная и даже полная ионизация атома. Далее мы будем, как правило, иметь дело с одноэлектронной ионизацией. В небольшом числе случаев, однако нам встретятся примеры и полной ионизации. Таков, в частности, случай двукратной ионизации атома гелия (Z = 2), в результате которой возникают 2 свободных электрона и 1 дважды положительно заряженный тяжелый ион Не++, т.е. полностью ионизированное ядро гелия, потерявшее всю свою электронную оболочку (рис. 1, б).
Энергия, необходимая для отрыва электрона от атома, определяется силой электростатического притяжения электрона к ядру. Поэтому она минимальна для наиболее слабо связанного электрона, находящегося на внешней орбите атома каждого химического элемента. Численные значения энергии ионизации атомов различных элементов выражают в специальных энергетических единицах — электрон-вольтах (эВ). Один электрон-вольт — это энергия, которую приобретает электрон, ускоренный разностью потенциалов 1 эВ. Минимальные значения энергии ионизации составляют от 3,9 — для атомов цезия до 24,6 эВ — для атомов гелия.
Наряду с ионизацией выше упомянут и другой процесс — возбуждение, т. е. переход электрона с одной фиксированной орбиты на другую, более удаленную от ядра. Возбуждение атома может быть следствием только увеличения его энергии, иными словами — поглощения энергии атомом.
В природе столь же часто наблюдается и обратный процесс: когда под влиянием каких-то факторов атом переходит из возбужденного состояния в основное, то избыток этой энергии уносит излучение. Вспомним, что положение электронных траекторий в пространстве и межорбитные расстояния между ними заданы законами микромира. Поэтому, когда электрон переходит с высокой орбиты на более низкую, возникает строго фиксированный квант энергии (рис. 2).
Теперь дополним наши общие соображения простейшими количественными соотношениями.
Когда такая квантовая система, как атом, переходит из возбужденного состояния с энергией Ев в основное с энергией Е0, то при этом излучается квант электромагнитного излучения с энергией
Эта запись представляет собой закон сохранения энергии при таком излучательном переходе. Коэффициент пропорциональности h = 6,62•10-27 эрг•с представляет собой элементарный квант действия, позднее названный постоянной Планка.
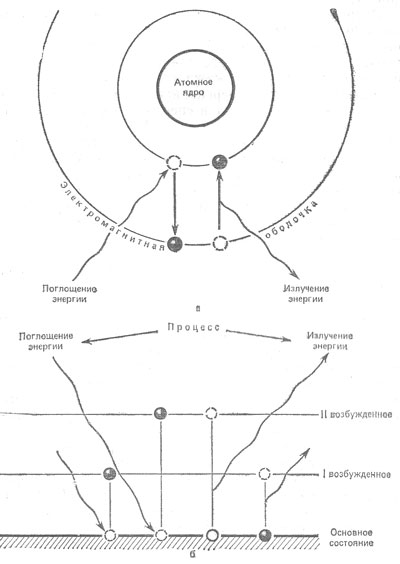
Рис. 2. Схема поглощения и излучения энергии атомом (а) и атомным ядром (б)
Современная волновая (или квантовая) механика базируется на представлении о том, что каждая частица с энергией Е обладает как корпускулярными (от латинского «корпускула» – частица), так и волновыми свойствами. В одних условиях она может проявлять свойства частиц, в других – волн с частотой ν, которая связана с энергией соотношением Эйнштейна-Планка:
Отсюда следует и обратное утверждение: в определенных условиях электромагнитное излучение с частотой ν может проявлять свойства частиц с энергией Е. Такие кванты электромагнитного излучения получили название фотонов.
При перестройке внешних электронных оболочек атомов возникают фотоны относительно малой энергии, то есть сравнительно длинноволновое излучение. Общеизвестным примером является солнечный свет с энергиями фотонов порядка 1,8 — 3,0 эВ и соответствующими длинами волн от 4000 А для фиолетовой до 7000 А для красной границ видимой области. Сопоставление энергии этих фотонов с указанными выше минимальными значениями потенциалов ионизации любых атомов (3,9 — 24,6 В) убедительно показывает, что это излучение не может вызвать ионизации при обычной его интенсивности2. Для образования одной пары ионов в различных газах необходима еще большая энергия — от 26 эВ в метане до 34 эВ в воздухе.
Перестройки атомных ядер, переход их из возбужденного состояния в основное сопровождаются возникновением весьма высокоэнергетичного, коротковолнового «жесткого» излучения, фотоны которого получили название γ-квантов. Характерные энергии этих фотонов — от 1 до 3 МэВ, соответствующие длины волн порядка 0,5 А.
Промежуточное положение между этими областями занимает рентгеновское излучение, названное в честь его первооткрывателя, немецкого физика Вильгельма Рентгена (1895 г.). Это излучение возникает в тех случаях, когда электроны, разогнанные до высоких скоростей в рентгеновской трубке, тормозятся атомами тяжелых металлов, из которых изготовляют аноды этих трубок. Электроны, выбитые из внутренних слоев электронных оболочек атомов анода, дают начало излучению каскада фотонов, энергия каждого из которых характерна для данного элемента. Оно так и называется характеристическим. В отличие от оптического диапазона в рентгеновском характеристическом излучении доминируют высокоэнергетические фотоны (например, в трубках со свинцовым антикатодом энергия квантов достигает 70 кэВ, а длина волны равна 0,2 А).
Спектр рентгеновского характеристического излучения разделяют на несколько серий, названных последовательностью букв латинского алфавита: K, L, M, N, O (рис. 2, б). Первая из них соответствует уровню энергии, наиболее близкому к ядру, на котором находятся электроны, особо прочно связанные в атоме. Расчетно и экспериментально установлено, что глубина K-уровня в 4 раза больше, чем L-уровня, и в 9 раз больше, чем глубина M-уровня. Глубина этих уровней пропорциональна Z2, откуда следует, что длина волны возбуждаемого характеристического излучения λ ~ √Z.
Обратим внимание на особый случай водорода: единственный электрон, образующий его «оболочку», может лишь перескакивать с одного уровня на другой при возбуждении атома. При выбивании же этого электрона из атома образующаяся «вакансия» не заполняется электронами более высоколежащих уровней, так как их там просто нет. Иначе дело обстоит в случае более тяжелых атомов: здесь «вакансию» выбитого K-электрона немедленно заполняет один из менее прочно связанных и более высоколежащих электронов, и происходит испускание одного или нескольких квантов характеристического излучения K, L, M-серий.
Наряду с характеристическим в спектре рентгеновского излучения присутствует и дает наибольший вклад в интенсивность другой вид излучения — тормозной. Это излучение, возникающее при торможении электрона за счет потери им своей начальной энергии в поле ядра, имеет непрерывный, спектр. По современным представлениям, рентгеновское излучение занимает область длин волн от 10-2 до 103 А (рис. 3).
Энергия фотонов рентгеновского и γ-излучений достаточна для ионизации. Поэтому их называют ионизирующими излучениями. Таким образом, на энергетической шкале излучения для нас представляет интерес только правая, высокоэнергетическая область.
Наш очередной шаг — познакомиться с радиоактивными3 излучениями, как они были названы их первооткрывателем, французским ученым Анри Беккерелем. В конце 1896 г он обнаружил, что уран с постоянной интенсивностью испускает проникающее излучение, то есть непрерывно выделяет энергию со скоростью, величину которой невозможно изменить никакими физическими и химическими воздействиями. Вскоре была выявлена радиоактивность еще одного тяжелого элемента — тория. В 1898 г. французские физики Пьер и Мария Кюри открыли 2 новых химических элемента конца таблицы Менделеева — радий и полоний, отличающиеся значительно более интенсивным излучением, чем уран и торий. Главное отличие радиоактивного излучения от описанных выше оптического и рентгеновского — отсутствие внешнего источника энергии, вызывающего его возникновение.
Вспомним, что, помимо протонов, в подавляющее большинство атомных ядер входят также тяжелые элементарные частицы другого типа — электрически нейтральные нейтроны. Единственным исключением является уже упоминавшийся простейший атом обычного водорода, ядро которого состоит из одиночного протона. Тяжелые частицы — положительно заряженные протоны и незаряженные нейтроны — объединяют под общим названием «нуклоны». Полное число нуклонов, т. е. сумма чисел протонов и нейтронов в ядре, определяет две взаимосвязанные важнейшие характеристики — массовое число A и полную энергию связи всех нуклонов в ядре, которая является мерой его стабильности. Чем ближе атом к концу таблицы Менделеева, тем больше A, выше доля нейтронов в ядре и тем менее устойчивы ядра этого элемента.
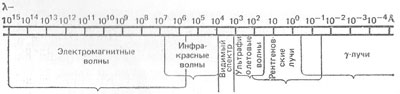
Рис. 3. Энергетическая шкала электромагнитного излучения
В начале таблицы Менделеева находятся особо «прочные» и поэтому наиболее распространенные во Вселенной элементы, в ядрах которых число протонов равно числу нейтронов. Примерами могут служить водород (Z = 1, А = 1), гелий (Z = 2, А = 4), углерод (Z = 6, A = 12). Здесь уместно отметить, что в современной ядерной физике вместо только что приведенной пространной записи вида ядра применяют более сжатую форму ЭА. В такой форме названным выше ядрам соответствуют символы Н1, Не4 и С12.
В начале и середине таблицы Менделеева «парные» взаимодействия протонов и нейтронов удерживают ядра в стабильном состоянии. В конце таблицы ядра сильно переобогащены нейтронами: число нейтронов в тяжелых ядрах превышает число протонов более чем в 1,5 раза. Например, в ядре урана 23892U на 92 протона приходится 238—92=146 нейтронов. Такие ядра (нуклиды) нестабильны и могут испытывать радиоактивный распад с выделением энергии. Время, за которое число имеющихся ядер уменьшается вдвое, является постоянной величиной, характерной для данного излучателя, и называется периодом полураспада. Таким образом,
Единицами измерения количества радиоактивных веществ являются кюри (Ки) и беккерель (Бк). Эти имена были только что упомянуты среди основателей ядерной физики.
Численному значению активности 1 Ки приблизительно соответствует активность 1 г радия в равновесии с продуктами его распада. За масштаб единицы 1 Бк взят 1 распад в 1 с. Между единицами существуют следующие взаимозависимости:
- 1 Ки = 37 млрд. расп. в 1 с = 37•109 Бк = 3,7•1010 Бк
- 1 Бк = 1 расп/с *= 0,3•10-10 Ки.
Поскольку ниже нам придется неоднократно применять дробные и кратные производные той или иной единицы измерений, напомним их латинские обозначения:
- 1 мегакюри (МКи) = 106 Ки = 3,7•1016 Бк,
- 1 килокюри (кКи) = 103 Ки = 3,7•1013 Бк,
- 1 милликюри (мКи) = 10-3 Ки = 3,7•107 Бк,
- 1 микрокюри (мкКи) = 10-6 Ки = 3,7•104 Бк,
- 1 нанокюри (нКи) = 10-9 Ки = 3,7•101 Бк = 37 Бк,
- 1 пикокюри (пКи) = 10-12 Ки = 3,7•10-2 Бк.
Удельная активность, или концентрация радиоактивного вещества, — это активность единицы массы или единицы объема какой-либо среды, например, 1 Ки на 1 л воздуха или 1 Бк на 1 г почвы (ввиду малости единицы 1 Бк ее чаще употребляют при измерениях радиоактивности объектов внешней среды).
Поместив препарат радия между полюсами магнита, физики обнаружили, что поток частиц, уносящих энергию возбужденного радиоактивного ядра, неоднороден. Он разделяется на 3 разновидности, названные тремя первыми буквами греческого алфавита: альфа-, бета-частицы и гамма-излучение. К концу 20-х годов удалось расшифровать их природу. Было доказано, что положительно заряженные α-частицы представляют собой дважды ионизированные ядра гелия, т. е. ионы Не++, или, иначе говоря, ядра гелия, полностью лишенные электронных оболочек. Отрицательно заряженные β-частицы — это быстрые электроны со скоростями, близкими к скорости света (3•1010 м/с). Электрически нейтральное γ-излучение оказалось потоком высокоэнергетичиых квантов электромагнитной энергии.
Ионы Не++, т. е. α-частицы, несущие двойной электрический заряд, буквально «продираются» через атомы вещества, быстро растрачивая свою первоначально высокую энергию на многократные акты ионизации. В итоге пробеги α-частиц очень малы — даже в воздухе при нормальном давлении они не превышают 10 см. Однократно заряженные β-частицы реже взаимодействуют с атомами среды. В результате пробеги β-частиц в воздухе достигают метра. Еще меньше вероятность ионизации среды γ-квантами – они настолько редко взаимодействуют с атомами воздуха, что пробегают в нем десятки метров. Поэтому-то γ-излучение и называют проникающим. Основные свойства α-, β- и γ-излучений приведены в табл. 1.
Таблица 1. Основные свойства α, β и γ-излучений естественных радиоактивных веществ.
| Излучение | Природа | Ионизирующая способность | Проникающая способность |
| α | Ион Не++ | Очень высокая | Низкая: 0,1 мм воды, лист бумаги |
| β | Электрон | Высокая | Высокая: до 0,5 мм алюминия |
| γ | Электромагнитное излучение | Низкая | Очень высокая: до нескольких сантиметров свинца |
Дальнейшими исследованиями установлено, что энергия радиоактивного распада выделяется в результате превращения одного тяжелого химического элемента в другой, более легкий. Перемещаясь в соответствии с так называемым правилом сдвига, естественно радиоактивные ядра в конце концов превращаются в стабильный свинец (табл. 2).
В 1934 г. французские физики Ирен и Фредерик Жолио-Кюри открыли, что в результате воздействия нейтронами на ядра стабильных элементов в них возникают изотопы с искусственной радиоактивностью. Сведения о некоторых искусственных радионуклидах приведены во второй части табл. 2. Особо отметим, что, подобно продуктам деления, их распад, как правило, сопровождается β- и γ-излучениями. На сегодня известно около 1700 искусственных радионуклидов.
Завершим этот раздел несколькими определениями основных понятий, с которыми нам придется далее постоянно иметь дело:
Таблица 2. Основные физические характеристики некоторых естественных и искусственных радионуклидов.
| Название | Символ | Z | A | Период полураспада | Вид излучения |
| Уран | U | 92 | 238 | 4,5•109 лет | α |
| 92 | 235 | 7•108 лет | α, γ | ||
| Протактиний | Pa | 91 | 231 | 3,4•104 лет | α, γ |
| Торий | Th | 90 | 232 | 1,4•1010 лет | α, γ |
| Актиний | Ac | 89 | 227 | 22 г. | β, γ |
| Радий | Ra | 88 | 226 | 1860 лет | α, γ |
| Радон | Rn | 86 | 222 | 3,8 сут | α |
| Полоний | Po | 84 | 210 | 138 сут | α |
| Свинец | Pb | 82 | 210 | 22 г. | β, γ |
| Калий | K | 19 | 40 | 4,5•108 лет | β, γ4 |
| Водород | H | 1 | 3 | 12 лет | β |
| Углерод | C | 6 | 14 | 5 700 лет | β |
| Фосфор | P | 15 | 32 | 14 сут | β |
| Криптон | Kr | 30 | 85 | 10,4 г. | β |
| Стронций | Sr | 38 | 89 | 50 сут | β, γ |
| 90 | 28 лет | β | |||
| Цирконий | Zr | 40 | 95 | 64 сут | β, γ |
| Ниобий | Nb | 41 | 95 | 35 сут | То же |
| Рутении | Ru | 44 | 103 | 39 сут | —»— |
| 106 | 368 сут | —»— | |||
| Иод | I | 53 | 131 | 8 сут | —»— |
| Цезий | Cs | 55 | 134 | 2 г. | —»— |
| 137 | 30 лет | —»— | |||
| Барий | Ba | 56 | 140 | 13 сут | —»— |
| Церий | Ce | 58 | 141 | 33 сут | —»— |
| 144 | 285 сут | —»— | |||
Ниже мы будем употреблять этот термин не только для обозначения элементарного акта, но и для совокупности таких событий, говоря об ионизации газа, жидкости, твердого тела и биологической ткани.
И еще два термина, без которых нам не обойтись:
облучение — процесс взаимодействия излучения со средой.
Внимательный читатель, видимо, обратил внимание, что в последнем определении отсутствует слово «ионизирующее». Это не упущение автора. Действительно нам известны многие виды излучений, и каждое из них может взаимодействовать с облучаемой средой. Одно из них всем хорошо знакомо буквально по собственной коже — вспомним последствия длительного пребывания летом на солнцепеке. Ожог (иногда второй степени!) — следствие переоблучения кожи в результате воздействия инфракрасного излучения на клетки эпидермиса, верхнего слоя кожи, тогда как загар — воздействие более глубоко проникающего ультрафиолетового излучения на пигмент в составе подкожной клетчатки при более продолжительной и менее интенсивной экспозиции.
Отмеченное в последние годы снижение слуха у подростков — последствие акустического переоблучения у домашних магнитофонов и в дискотеках. Причина выявленной в годы второй мировой войны анемии (угнетения кроветворения) у операторов мощных радиолокаторов — воздействие чрезвычайно больших доз сверхвысокочастотного электромагнитного излучения, сопровождающего работу генераторов этих установок. Одна из интереснейших в современной биофизике гипотез связывает акселерацию людей в послевоенные годы с переоблучением всего населения Земли вездесущими радиоволнами.
Не умножая число таких примеров, уточним нашу цель — количественно обосновать безопасные и допустимые уровни воздействия ионизирующих излучений на живые организмы и оценить степень опасности облучения человека.
Мы будем рассматривать лишь 3 вида ионизирующих излучений: α- и β-частицы и γ-кванты (фотоны) рентгеновского или γ-излучения. Упомянем также нейтроны, главным источником которых в наши дни являются ядерные реакторы.
В каждом акте деления урана возникает от 2 до 3 нейтронов, а каждый ватт энергии, выделенной в реакторе, — это 30•109 (30 миллиардов!) таких элементарных событий микромира. Поэтому при эксплуатации АЭС одна из главных задач обеспечения радиационной безопасности — снижение потоков нейтронов в рабочей зоне до допустимого уровня. Однако при оценке опасности облучения на примере чернобыльской аварии нас не может интересовать защита от нейтронов — ядерный реактор IV блока ЧАЭС прекратил свою работу в момент взрыва. Цепная реакция деления ядер урана прекратилась в тот же миг. Великолепное инженерное сооружение превратилось в груду обломков, не способную генерировать нейтроны. Вместо этого обнажившиеся из-под экранирующей защиты остатки активной зоны и выброс радионуклидов из еще не остывшего ядерного топлива, лишенного теплоотвода, с особенной остротой поставили вопросы радиационной защиты персонала АЭС и населения прилегающих районов от α-, β- и γ-излучений5.
Сноска 3: От латинского «radio» — излучаю, «radius» — луч и «activus» — действенный.
Последнее изменение Tue, 6 Dec 2011 автором Dimouse
0 comments
Назад в раздел Ю.В. Сивинцев "Насколько опасно облучение"















